 Sobald
sich etwas Gas in der Flüssigkeit gelöst hat, findet auch
eine Umkehrung des Lösungsvorgangs statt: die gelösten
Gasteilchen gehen wieder in den Gasraum über, verlassen also die
Flüssigkeit. (Siehe Bild C)
Sobald
sich etwas Gas in der Flüssigkeit gelöst hat, findet auch
eine Umkehrung des Lösungsvorgangs statt: die gelösten
Gasteilchen gehen wieder in den Gasraum über, verlassen also die
Flüssigkeit. (Siehe Bild C)Partialdruck in Gasen und Flüssigkeiten
Definition: Der Partialdruck ist der Teildruck eines Gases,
d.h. sein Anteil am Gesamtdruck bei einem Gasgemisch
PGas A = Pgesamt * AnteilGas A
Modellvorstellung:
Den Druck eines Gases können wir uns verdeutlichen als das Maß für die Stärke, mit dem bewegliche Gasmoleküle gegen eine Wand (oder ein Manometer) stoßen. Diese Stärke ist abhängig von der Zahl der stoßenden Teilchen, die pro Flächeneinheit auf die Wand stoßen, und ihre Bewegungsenergie (Temperatur!)
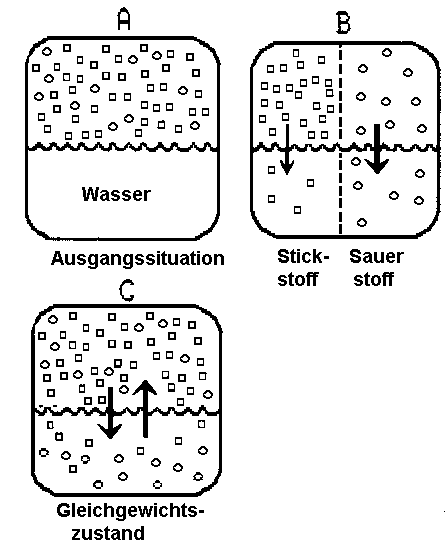
Wir betrachten eine Flüssigkeit. Anfangs sei kein Gas in der Flüssigkeit gelöst. Wird diese Flüssigkeit an die Luft gebracht, so lösen sich von allen in der Luft enthaltenen Gasen Teile im Wasser, z.B. (wenn wir nur Sauerstoff und Stickstoff betrachten):
s. Abbildung: A: Gesamtbild B: der Stickstoffanteil und der Sauerstoffanteil getrennt betrachtet
 Sobald
sich etwas Gas in der Flüssigkeit gelöst hat, findet auch
eine Umkehrung des Lösungsvorgangs statt: die gelösten
Gasteilchen gehen wieder in den Gasraum über, verlassen also die
Flüssigkeit. (Siehe Bild C)
Sobald
sich etwas Gas in der Flüssigkeit gelöst hat, findet auch
eine Umkehrung des Lösungsvorgangs statt: die gelösten
Gasteilchen gehen wieder in den Gasraum über, verlassen also die
Flüssigkeit. (Siehe Bild C)
Dieser Austritt von Gasteilchen aus der Flüssigkeit ist umso größer,
- desto mehr Gasteilchen sich bereits in der Flüssigkeit befinden und
- desto kleiner die Löslichkeit des Gases in der Flüssigkeit ist. (Sättigungswert)
Der Sättigungswert des Gases ist ein dynamischer Gleichgewichtszustand.
Wodurch ist dieser Gleichgewichtszustand charakterisiert?
.............................................................
Je höher der Partialdruck des betreffenden Gases ist, umso mehr Gasteilchen treffen auf die Oberfläche der Lösung, umso höher ist also der Sättigungswert. Im Gleichgewichtszustand ist der Partialdruck des gelösten Gases gleich dem Partialdruck des Gases im Gasraum (z.B. Luft).
Bei O°C lösen sich in 1 l Wasser 23 cm3 Stickstoff und 49 cm3 Sauerstoff. Der Stickstoffanteil an der Luft beträgt ca.8O %.
Wie groß ist der Partialdruck des gelösten Stickstoffs bzw.Sauerstoffs bei 102 kPa Luftdruck?
(Vorsicht Falle: Die Aufgabe ist leichter lösbar als es zuerst erscheint!)